Potentiel d’oxydo-réduction (HU) : Différence entre versions
m (1 version) |
|||
| Ligne 1 : | Ligne 1 : | ||
''<u>Traduction anglaise</u> : Redox potential'' | ''<u>Traduction anglaise</u> : Redox potential'' | ||
| − | Le potentiel d'oxydoréduction (également appelé potentiel | + | Le potentiel d'oxydoréduction (également appelé potentiel rédox) mesure l'équilibre entre les formes oxydées et réduites des différents composés chimiques. |
| − | rédox) mesure l'équilibre entre les formes oxydées et réduites des différents | + | |
| − | composés chimiques. | + | |
== Méthode de calcul == | == Méthode de calcul == | ||
| − | Pour un couple oxydant/réducteur donné, le potentiel | + | Pour un couple oxydant/réducteur donné, le potentiel d'oxydoréduction E du couple exprimé en volts se met sous la forme suivante (équation de Nernst) : |
| − | d'oxydoréduction E du couple exprimé en volts se met sous la forme suivante | + | |
| − | (équation de Nernst) : | + | |
| − | <center> | + | <center><math>E=E^0_{(Ox/Red)}+\frac{R.T}{n.F}log(\frac{}{})</math></center> |
(1) | (1) | ||
| Ligne 19 : | Ligne 15 : | ||
Avec : | Avec : | ||
| − | + | * E0 : potentiel normal correspondant à l'équilibre lorsque les concentrations des formes oxydées et réduites sont égales (en V) ; | |
| − | + | * n : nombre d'électrons échangés ; | |
| − | à l'équilibre lorsque les concentrations des formes oxydées et réduites sont | + | * R : constante molaire des gaz parfaits (8,314 J.mol-1.K-1) ; |
| − | égales (en V) ; | + | * T : température absolue (K) ; |
| + | * F : constante de Faraday (96 485 C.mol-1). | ||
| − | |||
| − | |||
| − | + | En pratique, on exprime les potentiels par rapport au potentiel d'une électrode normale à hydrogène (EH) de référence dont la valeur est fixée à zéro. A titre d'exemple, le potentiel d'oxydoréduction E0 du couple Fe2+ / Fe3+ vaut 0,77 volts. Plus E0 est élevé, plus l'oxydant est fort. | |
| − | + | ||
| − | + | Les réactions et les équilibres d'oxydoréduction sont fonction du [[pH (HU)|pH]] du milieu. Le pouvoir oxydoréducteur, noté rH, permet d'associer les notions de pH et de potentiel d'oxydoréduction en une seule grandeur donnée par la relation : | |
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | Les réactions et les équilibres d'oxydoréduction sont | + | |
| − | fonction du [[pH (HU)|pH]] du milieu. Le pouvoir oxydoréducteur, | + | |
| − | noté rH, permet d'associer les notions de pH et de potentiel d'oxydoréduction | + | |
| − | en une seule grandeur donnée par la relation : | + | |
| Ligne 55 : | Ligne 32 : | ||
(2) | (2) | ||
| − | Le milieu est réducteur avec dégagement d'hydrogène pour | + | Le milieu est réducteur avec dégagement d'hydrogène pour rH < 0, et oxydant avec dégagement d'oxygène pour rH > 27. |
| − | rH < 0, et oxydant avec dégagement d'oxygène pour rH > 27. | + | |
== Application en hydrologie urbaine == | == Application en hydrologie urbaine == | ||
| − | La mesure du potentiel d'oxydoréduction est effectuée avec | + | La mesure du potentiel d'oxydoréduction est effectuée avec une électrode de référence au calomel et une électrode de mesure en argent ou en platine. Dans un effluent urbain ou dans un cours d'eau contenant de très nombreux composés sous formes oxydées et réduites, le potentiel d'oxydoréduction ne peut pas s'écrire de manière simple, et correspond à une indication globale sur l'état oxydant ou réducteur du milieu. Selon les valeurs mesurées, il est possible d'en déduire la probabilité de présence ou non de certaines espèces chimiques. Par exemple, l'azote est présent sous forme de nitrates en milieu oxydant, et sous forme d'ammonium en milieu réducteur. La mesure du potentiel d'oxydoréduction constitue ainsi un très bon indicateur de l'état et de l'activité microbiologique globale du milieu étudié. Une mesure conjointe du pH est également indispensable pour caractériser plus finement le milieu. Dans la pratique, le rH est donc l'une des grandeurs intégratrices les plus commodes pour caractériser l'état d'un milieu (Voir la figure ci-dessous). |
| − | une électrode de référence au calomel et une électrode de mesure en argent ou | + | |
| − | en platine. Dans un effluent urbain ou dans un cours d'eau contenant de très nombreux | + | |
| − | composés sous formes oxydées et réduites, le potentiel d'oxydoréduction ne peut | + | |
| − | pas s'écrire de manière simple, et correspond à une indication globale sur | + | |
| − | l'état oxydant ou réducteur du milieu. Selon les valeurs mesurées, il est | + | |
| − | possible d'en déduire la probabilité de présence ou non de certaines espèces | + | |
| − | chimiques. Par exemple, l'azote est présent sous forme de nitrates en milieu | + | |
| − | oxydant, et sous forme d'ammonium en milieu réducteur. La mesure du potentiel | + | |
| − | d'oxydoréduction constitue ainsi un très bon indicateur de l'état et de | + | |
| − | l'activité microbiologique globale du milieu étudié. Une mesure conjointe du pH | + | |
| − | est également indispensable pour caractériser plus finement le milieu. Dans la | + | |
| − | pratique, le rH est donc l'une des grandeurs intégratrices les plus commodes | + | |
| − | pour caractériser l'état d'un milieu (Voir la figure ci-dessous). | + | |
| Ligne 81 : | Ligne 44 : | ||
| − | Diagramme potentiel-pH des eaux résiduaires urbaines | + | Diagramme potentiel-pH des eaux résiduaires urbaines [Degrémont, 1989]. |
| − | [Degrémont, 1989]. | + | |
Voir aussi [[Oxydoréduction (HU)|Oxydo-réduction]]. | Voir aussi [[Oxydoréduction (HU)|Oxydo-réduction]]. | ||
| − | [[Catégorie: | + | [[Catégorie:Dictionnaire_DEHUA]] |
Version du 19 janvier 2020 à 12:46
Traduction anglaise : Redox potential
Le potentiel d'oxydoréduction (également appelé potentiel rédox) mesure l'équilibre entre les formes oxydées et réduites des différents composés chimiques.
Méthode de calcul
Pour un couple oxydant/réducteur donné, le potentiel d'oxydoréduction E du couple exprimé en volts se met sous la forme suivante (équation de Nernst) :
(1)
Avec :
- E0 : potentiel normal correspondant à l'équilibre lorsque les concentrations des formes oxydées et réduites sont égales (en V) ;
- n : nombre d'électrons échangés ;
- R : constante molaire des gaz parfaits (8,314 J.mol-1.K-1) ;
- T : température absolue (K) ;
- F : constante de Faraday (96 485 C.mol-1).
En pratique, on exprime les potentiels par rapport au potentiel d'une électrode normale à hydrogène (EH) de référence dont la valeur est fixée à zéro. A titre d'exemple, le potentiel d'oxydoréduction E0 du couple Fe2+ / Fe3+ vaut 0,77 volts. Plus E0 est élevé, plus l'oxydant est fort.
Les réactions et les équilibres d'oxydoréduction sont fonction du pH du milieu. Le pouvoir oxydoréducteur, noté rH, permet d'associer les notions de pH et de potentiel d'oxydoréduction en une seule grandeur donnée par la relation :
(2)
Le milieu est réducteur avec dégagement d'hydrogène pour rH < 0, et oxydant avec dégagement d'oxygène pour rH > 27.
Application en hydrologie urbaine
La mesure du potentiel d'oxydoréduction est effectuée avec une électrode de référence au calomel et une électrode de mesure en argent ou en platine. Dans un effluent urbain ou dans un cours d'eau contenant de très nombreux composés sous formes oxydées et réduites, le potentiel d'oxydoréduction ne peut pas s'écrire de manière simple, et correspond à une indication globale sur l'état oxydant ou réducteur du milieu. Selon les valeurs mesurées, il est possible d'en déduire la probabilité de présence ou non de certaines espèces chimiques. Par exemple, l'azote est présent sous forme de nitrates en milieu oxydant, et sous forme d'ammonium en milieu réducteur. La mesure du potentiel d'oxydoréduction constitue ainsi un très bon indicateur de l'état et de l'activité microbiologique globale du milieu étudié. Une mesure conjointe du pH est également indispensable pour caractériser plus finement le milieu. Dans la pratique, le rH est donc l'une des grandeurs intégratrices les plus commodes pour caractériser l'état d'un milieu (Voir la figure ci-dessous).
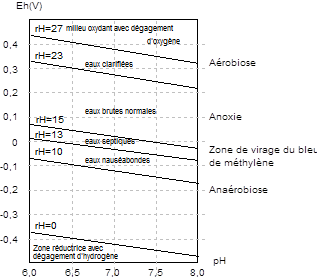
Diagramme potentiel-pH des eaux résiduaires urbaines [Degrémont, 1989].
Voir aussi Oxydo-réduction.
 S'abonner à un flux RSS
S'abonner à un flux RSS