Cadmium (HU) : Différence entre versions
| Ligne 1 : | Ligne 1 : | ||
''<u>Traduction anglaise</u> : Cadmium'' | ''<u>Traduction anglaise</u> : Cadmium'' | ||
| − | Le Cadmium est un métal relativement rare dans la nature On | + | <u>Dernière mise à jour</u> : 15/4/2020 |
| − | le rencontre généralement à l'état de traces, en association avec d'autres | + | |
| − | métaux non ferreux, en particulier avec le [[Zinc (HU)|zinc]] | + | Métal assimilé aux métaux de transition et présentant une toxicité et une écotoxicite importante. |
| − | dont il partage bon nombre de caractéristiques physico-chimiques. Les sources | + | |
| − | naturelles de cadmium sont les volcans, les incendies de forêts et les embruns | + | ==Origine du cadmium dans les eaux urbaines== |
| − | océaniques. En ville, les sources industrielles sont beaucoup plus importantes. | + | |
| − | Le cadmium est utilisé pour protéger l'acier, dans un grand nombre de pigments, | + | Le Cadmium est un métal relativement rare dans la nature. On le rencontre généralement à l'état de traces, en association avec d'autres métaux non ferreux, en particulier avec le [[Zinc (HU)|zinc]] dont il partage bon nombre de caractéristiques physico-chimiques. Les sources naturelles de cadmium sont les volcans, les incendies de forêts et les embruns océaniques. En ville, les sources industrielles sont beaucoup plus importantes. Le cadmium est utilisé pour protéger l'acier, dans un grand nombre de pigments, dans des agents stabilisants, dans des batteries (en association avec du nickel), etc. Seul environ 5% du cadmium utilisé est recyclé, ce qui a d'importantes conséquences environnementales. |
| − | dans des agents stabilisants, dans des batteries (en association avec du | + | |
| − | nickel), etc. Seul environ 5% du cadmium utilisé est recyclé, ce qui a | + | ==Formes physico-chimiques et concentrations dans les eaux urbaines== |
| − | d'importantes conséquences environnementales. Dans l'eau pure, le cadmium se | + | |
| − | trouve principalement sous la forme d'ions | + | Dans l'eau pure, le cadmium se trouve principalement sous la forme d'ions Cd_2<sup>+</sup, qui peuvent représenter jusqu'à 92% du cadmium total. Lorsque la teneur en sel augmente, on voit apparaître des chlorures (CdCl<sup>+</sup>, CdCl_2, CdCl_3<sup>-</sup). Ces chlorures s'adsorbent moins facilement sur les particules que d'autres complexes à base de cadmium. La complexation du cadmium semble augmenter en présence d'effluents sanitaires urbains. On a ainsi observé dans certaines eaux que 51% du cadmium se trouvait sous la forme d'ions libres, 20% sous la forme de complexes humiques et 3,6% sous la forme CdOH<sup>+</sup. Même lorsque le cadmium est présent dans la phase solide, il est essentiellement associé avec la fraction échangeable et donc très facilement remobilisable en cas de modification des conditions environnementales ([[pH (HU)|pH]], [[Potentiel d’oxydo-réduction (HU)|potentiel redox]], salinité, etc.). Les concentrations moyennes qui ont été mesurées dans les rejets urbains de temps de pluie vont de 0 (inférieures au seuil de détection) à 50μg/L. L'essentiel du cadmium se trouve dans la phase dissoute et seule la fraction organique et la fraction échangeable se retrouve dans la phase solide. Pendant son transfert dans le réseau de transport, le cadmium a tendance à s'associer avec des formes ioniques, faiblement complexées, et seul de 30 à 40% du cadmium est effectivement sous une forme très facilement biodisponible lors du rejet. |
| − | représenter jusqu'à 92% du cadmium total. Lorsque la teneur en sel augmente, on | + | |
| − | voit apparaître des chlorures (CdCl+, | + | ==Toxicité du cadmium== |
| − | Ces chlorures s'adsorbent moins facilement sur les particules que d'autres | + | |
| − | complexes à base de cadmium. La complexation du cadmium semble augmenter en | + | La [[Toxicité (HU)|toxicité]] du cadmium pour les poissons d'eau douce a été beaucoup étudiée, et une norme européenne recommande de ne pas dépasser une concentration de 5μg/L. La dureté de l'eau et sa température influent sur la toxicité du cadmium pour les poissons, spécialement aux stades juvéniles, lorsque les espèces sont les plus vulnérables. Les données issues de tests de toxicité effectués sur des macro-invertèbrés suggèrent que ce sont les crustacés qui sont les espèces les plus sensibles. Pour les humains le cadmium provoque différentes pathologies : hypertension, anémie, troubles de la croissance, anomalies cardiaques, altérations du foie et des reins. Un empoisonnement par du cadmium étudié au japon dans les années 50 (maladie de Itai-Itai) est connu pour avoir provoqué des lumbagos extrêmement violents et des troubles de la mobilité. |
| − | présence d'effluents sanitaires urbains. On a ainsi observé dans certaines eaux | + | |
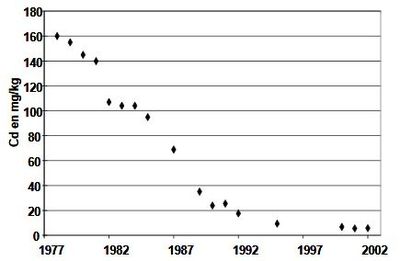
| − | que 51% du cadmium se trouvait sous la forme d'ions libres, 20% sous la forme | + | La concentration en cadmium des boues de station d'épuration a beaucoup diminué au cours des 30 dernières années (voir ''Figure 1'') et elle est généralement en dessous de la limite de référence pour l'utilisation agricole qui est fixée à 20 mg/kg de matière sèche (40 mg/kg en valeur limite). |
| − | de complexes humiques et 3,6% sous la forme CdOH+. Même lorsque le | + | |
| − | cadmium est présent dans la phase solide, il est essentiellement associé avec | + | [[File:cadmium.JPG|400px|center|thumb|<center>''<u>Figure 1</u>. Concentrations moyennes annuelles en cadmium des boues d’Achères (Seine aval) en fonction du temps ; <u>Source</u> : Baize ''et al'' (2006).''</center>]] |
| − | la fraction échangeable et donc très facilement remobilisable en cas de | + | |
| − | modification des conditions environnementales ([[pH (HU)|pH]], | + | <u>Bibliographie</u> : |
| − | [[Potentiel d’oxydo-réduction (HU)|potentiel redox]], | + | * Baize, D., Courbe, C., Suc, O., Schwartz, C., Tercé, M., Bispo, A., Sterckman, T., Ciesielski, H. (2006) : Épandages de boues d’épuration urbaines sur des terres agricoles : impacts sur la composition en éléments en traces des sols et des grains de blé tendre ; Courrier de l’environnement de l’INRA n°53, décembre 2006 ; téléchargeable sur : https://hal.archives-ouvertes.fr/hal-01199208/file/C53Baize.pdf |
| − | salinité, etc.). Les concentrations moyennes qui ont été mesurées dans les | + | |
| − | rejets urbains de temps de pluie vont de 0 (inférieures au seuil de détection) | + | |
| − | à | + | |
| − | seule la fraction organique et la fraction échangeable se retrouve dans la | + | |
| − | phase solide. Pendant son transfert dans le réseau de transport, le cadmium a | + | |
| − | tendance à s'associer avec des formes ioniques, faiblement complexées, et seul | + | |
| − | de 30 à 40% du cadmium est effectivement sous une forme très facilement | + | |
| − | biodisponible lors du rejet. La [[Toxicité (HU)|toxicité]] | + | |
| − | du cadmium pour les poissons d'eau douce a été beaucoup étudiée, et une norme | + | |
| − | européenne recommande de ne pas dépasser une concentration de | + | |
| − | poissons, spécialement aux stades juvéniles, lorsque les espèces sont les plus | + | |
| − | vulnérables. Les données issues de tests de toxicité effectués sur des | + | |
| − | + | ||
| − | plus sensibles. Pour les humains le cadmium provoque différentes | + | |
| − | pathologies : hypertension, anémie, troubles de la croissance, anomalies | + | |
| − | cardiaques, altérations du foie et des reins. Un empoisonnement par du cadmium | + | |
| − | étudié au japon dans les années 50 (maladie de Itai-Itai) est connu pour avoir | + | |
| − | provoqué des lumbagos extrêmement violents et des troubles de la mobilité. | + | |
| − | concentration limite de référence pour l'utilisation agricole | + | |
| − | + | ||
| − | + | ||
| − | + | ||
| − | <u> | + | |
[[Catégorie:Dictionnaire_DEHUA]] | [[Catégorie:Dictionnaire_DEHUA]] | ||
Version du 15 avril 2020 à 15:20
Traduction anglaise : Cadmium
Dernière mise à jour : 15/4/2020
Métal assimilé aux métaux de transition et présentant une toxicité et une écotoxicite importante.
Origine du cadmium dans les eaux urbaines
Le Cadmium est un métal relativement rare dans la nature. On le rencontre généralement à l'état de traces, en association avec d'autres métaux non ferreux, en particulier avec le zinc dont il partage bon nombre de caractéristiques physico-chimiques. Les sources naturelles de cadmium sont les volcans, les incendies de forêts et les embruns océaniques. En ville, les sources industrielles sont beaucoup plus importantes. Le cadmium est utilisé pour protéger l'acier, dans un grand nombre de pigments, dans des agents stabilisants, dans des batteries (en association avec du nickel), etc. Seul environ 5% du cadmium utilisé est recyclé, ce qui a d'importantes conséquences environnementales.
Formes physico-chimiques et concentrations dans les eaux urbaines
Dans l'eau pure, le cadmium se trouve principalement sous la forme d'ions Cd_2+</sup, qui peuvent représenter jusqu'à 92% du cadmium total. Lorsque la teneur en sel augmente, on voit apparaître des chlorures (CdCl+, CdCl_2, CdCl_3-</sup). Ces chlorures s'adsorbent moins facilement sur les particules que d'autres complexes à base de cadmium. La complexation du cadmium semble augmenter en présence d'effluents sanitaires urbains. On a ainsi observé dans certaines eaux que 51% du cadmium se trouvait sous la forme d'ions libres, 20% sous la forme de complexes humiques et 3,6% sous la forme CdOH+</sup. Même lorsque le cadmium est présent dans la phase solide, il est essentiellement associé avec la fraction échangeable et donc très facilement remobilisable en cas de modification des conditions environnementales (pH, potentiel redox, salinité, etc.). Les concentrations moyennes qui ont été mesurées dans les rejets urbains de temps de pluie vont de 0 (inférieures au seuil de détection) à 50μg/L. L'essentiel du cadmium se trouve dans la phase dissoute et seule la fraction organique et la fraction échangeable se retrouve dans la phase solide. Pendant son transfert dans le réseau de transport, le cadmium a tendance à s'associer avec des formes ioniques, faiblement complexées, et seul de 30 à 40% du cadmium est effectivement sous une forme très facilement biodisponible lors du rejet.
Toxicité du cadmium
La toxicité du cadmium pour les poissons d'eau douce a été beaucoup étudiée, et une norme européenne recommande de ne pas dépasser une concentration de 5μg/L. La dureté de l'eau et sa température influent sur la toxicité du cadmium pour les poissons, spécialement aux stades juvéniles, lorsque les espèces sont les plus vulnérables. Les données issues de tests de toxicité effectués sur des macro-invertèbrés suggèrent que ce sont les crustacés qui sont les espèces les plus sensibles. Pour les humains le cadmium provoque différentes pathologies : hypertension, anémie, troubles de la croissance, anomalies cardiaques, altérations du foie et des reins. Un empoisonnement par du cadmium étudié au japon dans les années 50 (maladie de Itai-Itai) est connu pour avoir provoqué des lumbagos extrêmement violents et des troubles de la mobilité.
La concentration en cadmium des boues de station d'épuration a beaucoup diminué au cours des 30 dernières années (voir Figure 1) et elle est généralement en dessous de la limite de référence pour l'utilisation agricole qui est fixée à 20 mg/kg de matière sèche (40 mg/kg en valeur limite).
Bibliographie :
- Baize, D., Courbe, C., Suc, O., Schwartz, C., Tercé, M., Bispo, A., Sterckman, T., Ciesielski, H. (2006) : Épandages de boues d’épuration urbaines sur des terres agricoles : impacts sur la composition en éléments en traces des sols et des grains de blé tendre ; Courrier de l’environnement de l’INRA n°53, décembre 2006 ; téléchargeable sur : https://hal.archives-ouvertes.fr/hal-01199208/file/C53Baize.pdf
 S'abonner à un flux RSS
S'abonner à un flux RSS