Spectrométrie (HU) : Différence entre versions
| Ligne 3 : | Ligne 3 : | ||
<u>Dernière mise à jour</u> : 08/01/2024 | <u>Dernière mise à jour</u> : 08/01/2024 | ||
| − | + | Ce terme désigne un ensemble de méthode permettant d'établir le spectre d'un phénomène physique, c'est-à-dire sa décomposition sur une échelle d'énergie (ou une autre grandeur similaire, le plus souvent sa longueur d'onde). | |
| − | + | En chimie et en biochimie on utilise le plus souvent ce terme pour désigner un ensemble de méthodes analytiques qui consistent à mesurer la capacité d'une substance chimique donnée, généralement en solution, à absorber un rayonnement en fonction de la longueur d'onde émise, de façon à en déduire sa présence et sa concentration. | |
| + | |||
| + | D'autres techniques analytiques de spectrométrie sont possibles, comme La spectrométrie de masse qui permet de séparer les constituants d'un mélange en fonction de leur masse et/ou de leur charge (https://culturesciences.chimie.ens.fr/thematiques/chimie-analytique/spectroscopies/qu-est-ce-que-la-spectrometrie-de-masse). | ||
| + | |||
| + | Seul le premier aspect sera présenté dans cet article. | ||
==Différence entre spectrométrie et spectrophotométrie== | ==Différence entre spectrométrie et spectrophotométrie== | ||
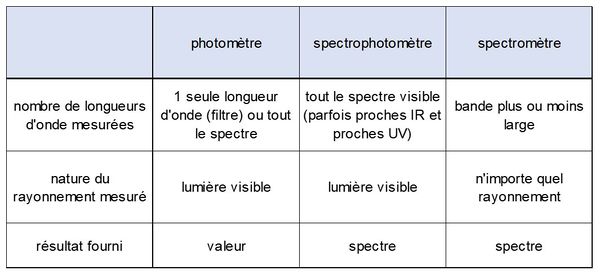
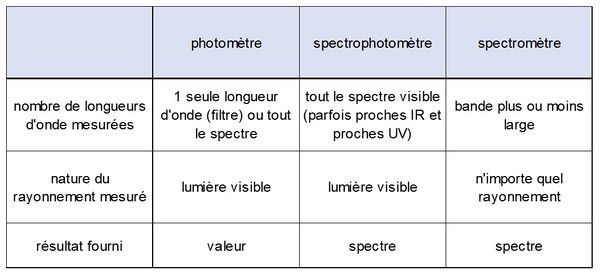
| − | Même si les deux mots sont proches, ils ne recouvrent pas | + | Même si les deux mots sont proches, ils ne recouvrent pas les mêmes méthodes : un spectromètre peut fonctionner pour tout rayonnement électromagnétique, quelle que soit sa longueur d'onde (depuis les rayons gamma : 10<sup>-11</sup> m jusqu'aux radiofréquences 10<sup>-4</sup> m), alors qu'un [[Spectrophotomètre (HU)|spectrophotomètre]] ne fonctionne que dans le domaine visible (parfois dans le proche infra-rouge ou le proche ultraviolet). Les sources et les capteurs utilisés en spectrométrie peuvent donc être totalement différents de ceux utilisés en spectrophotométrie et un spectrophotomètre constitue un type particulier de spectromètre. |
[[File:spectrophotomètre.JPG|600px|center|thumb|<center>''<u>Figure 1</u> : Différences entre photomètres, spectrophotomètre et spectromètre.''</center>]] | [[File:spectrophotomètre.JPG|600px|center|thumb|<center>''<u>Figure 1</u> : Différences entre photomètres, spectrophotomètre et spectromètre.''</center>]] | ||
| − | ==Principe | + | ==Principe des dosages spectrométriques== |
Le principe du dosage spectrométrique d'une substance consiste à utiliser la relation existant entre l'absorbance de la solution et la concentration de la substance étudiée. | Le principe du dosage spectrométrique d'une substance consiste à utiliser la relation existant entre l'absorbance de la solution et la concentration de la substance étudiée. | ||
Version du 8 janvier 2024 à 18:59
Traduction anglaise : Spectrometry
Dernière mise à jour : 08/01/2024
Ce terme désigne un ensemble de méthode permettant d'établir le spectre d'un phénomène physique, c'est-à-dire sa décomposition sur une échelle d'énergie (ou une autre grandeur similaire, le plus souvent sa longueur d'onde).
En chimie et en biochimie on utilise le plus souvent ce terme pour désigner un ensemble de méthodes analytiques qui consistent à mesurer la capacité d'une substance chimique donnée, généralement en solution, à absorber un rayonnement en fonction de la longueur d'onde émise, de façon à en déduire sa présence et sa concentration.
D'autres techniques analytiques de spectrométrie sont possibles, comme La spectrométrie de masse qui permet de séparer les constituants d'un mélange en fonction de leur masse et/ou de leur charge (https://culturesciences.chimie.ens.fr/thematiques/chimie-analytique/spectroscopies/qu-est-ce-que-la-spectrometrie-de-masse).
Seul le premier aspect sera présenté dans cet article.
Sommaire |
Différence entre spectrométrie et spectrophotométrie
Même si les deux mots sont proches, ils ne recouvrent pas les mêmes méthodes : un spectromètre peut fonctionner pour tout rayonnement électromagnétique, quelle que soit sa longueur d'onde (depuis les rayons gamma : 10-11 m jusqu'aux radiofréquences 10-4 m), alors qu'un spectrophotomètre ne fonctionne que dans le domaine visible (parfois dans le proche infra-rouge ou le proche ultraviolet). Les sources et les capteurs utilisés en spectrométrie peuvent donc être totalement différents de ceux utilisés en spectrophotométrie et un spectrophotomètre constitue un type particulier de spectromètre.
Principe des dosages spectrométriques
Le principe du dosage spectrométrique d'une substance consiste à utiliser la relation existant entre l'absorbance de la solution et la concentration de la substance étudiée.
Loi de Beer-Lambert
On définit l'absorbance $ A_λ $ d'une solution pour la longueur d'onde $ λ $ par la relation (1) :
Avec :
- $ I_0 $ : intensité du faisceau incident pour la longueur d'onde $ λ $ ;
- $ I $ : intensité transmise pour la longueur d'onde $ λ $.
La loi de Beer-Lambert permet de relier cette absorbance à la concentration par la relation (2) :
Avec :
- $ ε_λ $ : coefficient d'extinction molaire pour la longueur d'onde $ λ $ (litres/mole/m) ;
- $ l $ : longueur traversée par le faisceau incident (m) ;
- $ C $ : concentration de la solution (moles/Litre).
Schéma de principe d'un spectromètre
La figure 1 explicite le schéma de principe d'un spectromètre (dans ce cas un spectrophotomètre).
La loi de Beer-Lambert reste linéaire pour des concentrations $ C $ peu élevées, et la lecture de l'intensité transmise $ I $ donne directement la concentration C après étalonnage de l'appareil.
Mise en œuvre de la spectrométrie dans le domaine de l'hydrologie et de l'assainissement
La spectrométrie permet de déterminer les concentrations dans les eaux de diverses substances en choisissant les longueurs d'onde correspondant à des capacités d'extinction spécifiques à ces substances. Cette technique peut se mettre en œuvre de différentes manières. Il est possible d'utiliser des sources monochromatique (une seule longueur d'onde) ou polychromatiques et ceci aussi bien dans le domaine visible (colorimétrie) que dans l'infrarouge ou l'ultraviolet. Il est possible d'analyser l'absorbance globale du faisceau ou de déterminer des spectres d'absorbance en fonction de la longueur d'onde.
Cette méthode est très fréquemment utilisée pour déterminer les concentrations de certains polluants dans les eaux, par exemple les nitrates (norme AFNOR NF T 90-012) et les orthophosphates (norme AFNOR NF T 90-023), les hydrocarbures (norme AFNOR NF-T 90.203), etc.
Elle est le plus souvent utilisée en laboratoire mais des appareils robustes sont également utilisés in situ pour mesurer en continu certaines substances, par exemple les MES ou la DCO (De Bénédittis et Bertrand-Krajewski, 2004).
Bibliographie :
- De Bénédittis, J., Bertrand-Krajewski J.-L. (2004) : Mesure de la concentration en polluants dans les eaux usées par spectrométrie UV-visible ; La Houille Blanche, N°4 (Juillet-Août 2006), pp. 136-142
Pour en savoir plus :
 S'abonner à un flux RSS
S'abonner à un flux RSS