Spectrométrie (HU)
Traduction anglaise : Spectrometry
Dernière mise à jour : 20/4/2020
Méthode analytique qui consiste à mesurer l'absorbance d'une substance chimique donnée, généralement en solution.
Principe de la spectrométrie
Le principe du dosage spectrométrique d'une substance consiste à utiliser la relation existant entre l'absorbance de la solution et la concentration de la substance étudiée.
Loi de Beer-Lambert
On définit l'absorbance $ A_λ $ d'une solution pour la longueur d'onde λ par la relation (1) :
Avec :
- $ I_0 $ : intensité du faisceau incident pour la longueur d'onde λ ;
- $ I $ : intensité transmise pour la longueur d'onde.
La loi de Beer-Lambert permet de relier cette absorbance à la concentration :
Méthode de dosage d'une substance colorée en solution absorbant (spectrophotométrie d'absorption moléculaire). La concentration est déterminée par application de la loi de Beer-Lambert qui s'écrit :
Avec :
- $ ε_λ $ : coefficient d'extinction molaire pour la longueur d'onde λ (litres/mole/m) ;
- $ l $ : longueur traversée par le faisceau incident (m) ;
- $ C $ : concentration de la solution (moles/Litre).
Schéma de principe d'un spectromètre
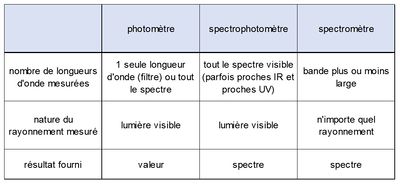
La loi de Beer-Lambert reste linéaire pour des concentrations $ C $ peu élevées, et la lecture de l'intensité transmise $ I $ donne directement la concentration C après étalonnage de l'appareil. Cette méthode est très fréquemment utilisée pour déterminer les concentrations de certains polluants dans les eaux, par exemple les nitrates (norme AFNOR NF T 90-012) et les orthophosphates (norme AFNOR NF T 90-023).
 S'abonner à un flux RSS
S'abonner à un flux RSS