Wikigeotech:Le bleu de méthylène
Le bleu de méthylène est un composé chimique utilisé dans le domaine de la géotechnique (NF P94-068[1]) et des granulats (NF EN 933-9+A1[2]) pour déterminer la valeur de bleu de méthylène par l'essai à la tache, essai couramment utilisé en France pour estimer la fraction argileuse contenue dans un matériau.
Sommaire
|
La molécule de bleu
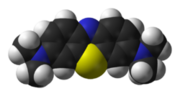
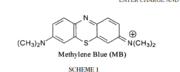
Le bleu de méthylène (ou chlorure de méthylthioninium) est un composé chimique aromatique hétérocyclique de formule moléculaire C16H18N3SCl avec une configuration géométrique rectangulaire plane de dimensions 17 Å × 7,6 Å × 3,25 Å (voir Figure).
A température ambiante, il apparaît sous forme d’une poudre solide vert foncée inodore. Le bleu de méthylène qui est un colorant cationique (cationic dye), c'est-à-dire portant une charge positive, donne une solution bleue une fois dissous dans l'eau. La forme hydratée de la molécule dispose de 3 molécules d'eau par molécule de bleu.
Propriétés de la molécule de bleu de méthylène
Compte-tenu de sa charge positive, la molécule de bleu de méthylène a la propriété de s'adsorber très facilement sur les surfaces des particules chargée négativement, ce qui est le cas de la majorité des argiles.
L’interaction entre le bleu de méthylène (ou Methylen Blue en anglais, ou MB) et les composants du sol ou des roches a été largement étudiée pendant une longue période au sein du Laboratoire Central des Ponts et Chaussées (actuellement Université Gustave Eiffel) (Tran, 1977[3], 1979[4], 1980[5], 1981[6]; Youssefian, 1989). Ces travaux mettent en évidence l'efficacité du bleu de méthylène en tant que colorant pour estimer la quantité de phases hydrophiles contenues dans les sols telles que l'argile, les oxydes, les silicates ferreux hydratés ou encore la matière organique. Or l'argilosité d'un sol (= nature et quantité d'argiles) peut avoir un impact sur les caractéristiques géotechniques et induire une diminution de certaines performances mécaniques lorsque le matériau qui en contient est en présence d'eau.
Les travaux de recherche ont montré de manière naturelle, une corrélation entre l’adsorption de la molécule de MB (en g/100 g) via des interactions électrostatiques, et les mesures de surface spécifique totale ou géométrique du matériau argileux (mesure réalisées par adsorption du 2-méthoxyéthanol ou EGME). Cette corrélation a été démontrée dès 1950 par Dyal et Hendricks, 1950[7].
Sachant que la molécule de bleu se présente sous la forme d’un parallélépipède dont les deux plus grands cotés mesurent respectivement 17 Å et 7,6 Å (ce qui donne une surface de 130 Å2 par molécule - Pham and Brindley, 1970[8]), une relation simple relie proportionnellement la quantité de MB adsorbé sur le matériau à la surface active de ce dernier. Or les argiles sont les minéraux qui présentent les surfaces spécifiques les plus importantes parmi les minéraux du sol. C'est plus particulièrement le cas des montmorillonites, qui sont des argiles dites "gonflantes" une fois mise au contact de l’eau. Les autres minéraux argileux quoique capables également d’adsorber la molécule de MB ne contribuent que peu à la valeur totale d’adsorption compte tenu de leur faible surface spécifique.
Ce calcul est cependant basé sur deux hypothèses fondamentales :
- les molécules de bleu s’adsorbent sous forme de monomères (molécules non agrégées) sur la surface du matériau,
- les molécules de bleu s’adsorbent de manière à ce que leur plus grande surface soit parallèle à la surface de l’argile.
Ces hypothèses peuvent s’avérer fausses dans certains cas (pour certaines argiles) et vraies dans d’autres. La mesure de la valeur de bleu n’est pas toujours corrélée de manière simple à la surface spécifique (totale) du matériau, que l’on suppose proportionnelle à la quantité et la sensibilité à l'eau des fines argileuses présentes.
L'adsorption des molécules de bleu à la surface des argiles
Les argiles sont des minéraux complexes, de forme et de composition très variées. Elles apparaissent dans ce nombreux cas sous forme de plaquette (kaolinite) ou de fueillets, ce qui a donné le nombre au groupe des phyllosilicates qui les contiennent.
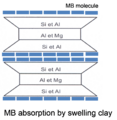
Le bleu de méthylène a la particularité de s'adsorber à la surface de ces particules. Selon la charge de l’argile et sa surface spécifique, les molécules de bleu vont s'adsorber sur la surface avec une orientation et/ou une agrégation qui peut perturber le calcul de la surface spécifique des argiles.
L'hypothèse la plus commune, est de considérer que la molécule de bleu de méthylène va s'adsorber sur la surface des particules sous la forme de monomères en monocouche. Ce n'est cependant pas toujours vrai.
Dans certains cas, la molécule peut être inclinée à 65 à 70° par rapport à la surface de l’argile (configuration de type « tuiles ») et non plus adsorbée parallèlement à la surface de la particule. Ainsi, la zone couverte est de 65 Å2 par molécule au lieu de 130 Å2 par molécule, ce qui modifie le calcul de la surface spécifique.
L'orientation de la molécule de bleu sur les surfaces
Le plan qui caractérise les groupements hétéro-aromatiques de la molécule de MB n'est pas toujours disposé parallèlement à la surface de l’argile comme supposé dans les études antérieures (Pham and Brindley, 1970[8]) mais plutôt de manière inclinée ou perpendiculaire sur les argiles (Kaneko et al., 2003[9] ; Kobayashi et al., 1996[10] ; Bujdak et al., 2003[11]) ou sur les films de Langmuir-Blodgett à base d’argile (Umemura, 2003[12]). La molécule est orientée de manière à ce que sa charge positive soit tournée vers la surface négative de l'argile (voir figure ci-dessous).
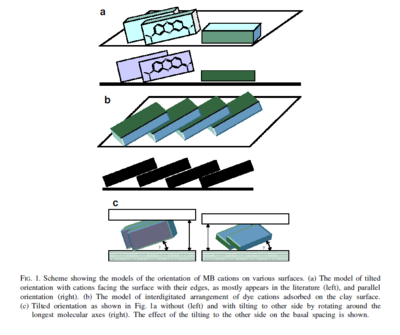
Cette figure illustre l'orientation des molécules de MB sur diverses surfaces (Bujdak et al., 2003[11]) :
- à gauche
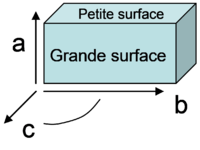
- a : Arrangement des molécules adsorbée dont la grande surface (plan ab) est perpendiculaire par rapport à la surface du minéral et inclinée avec une rotation par rapport à l’axe c (configuration très répandue dans la littérature) ;
- b : Arrangement face contre face des faces (ab) des molécules inclinées comme des tuiles sur un toit ;
- c : Orientation inclinée avec un tilt autour des axes moléculaires.
- à droite : Orientation classique avec la grande surface (plan ab) de la molécule parallèle à la surface du minéral ;
De plus, tout en gardant le plan moléculaire du colorant perpendiculaire par rapport au plan de la surface de l'argile, l'axe longitudinal de la molécule de MB peut être non parallèle ou incliné à de faibles angles par rapport au plan de surface de l'argile (Bujdak et al., 2003[11]).
Seule l'orientation inclinée sur la Figure (a) est adaptée pour former en même temps des agrégats de MB de grande taille sur les surfaces et pour fournir une interaction électrostatique entre la surface chargée négativement de l’argile et chaque site cationique du colorant adsorbé.
Plusieurs articles ont été publiés sur l'orientation de la molécule de MB adsorbée sur différents types de surfaces non-argileuses. Essentiellement, c’est une orientation moléculaire de MB parallèle à la surface qui a été observée. Dans le cas des argiles par contre, l'angle d’inclinaison de la molécule de MB est modifié par la charge des feuillets argileux, et l'interaction électrostatique entre la surface chargée négativement des argiles et le groupe chargé positivement de la molécule de MB joue probablement un rôle majeur (Bujdak et al., 2008[13]). Pour illustration, la spectroscopie de photoélectrons XPS et la technique XANES (qui signifie X-ray Absorption Near Edge Structure soit en français Spectroscopie de structure près du front d'absorption de rayons X), toutes deux réalisées avec un faisceau polarisé, montrent de manière directe que les molécules de MB sont inclinées à un angle d'environ 65-70° par rapport au plan de surface du mica (Hähner et al. 1996[14]). La densité de charge élevée sur les surfaces de mica pourrait contribuer à la forte densité de colorant cationique adsorbé et, ainsi, accroître l’angle d'orientation moyen des molécules.
Les agrégats de molécules de bleu de méthylène
La molécule de bleu de méthylène peut s'agréger en agrégats de différents types :
- les agrégats-H (MB+)3 : il s'agit de la forme la plus énergétique et donc la moins stable pour la molécule ;
- les dimères-H (MB+)2;
- les agrégats-J (MB+2) ou MBH2+ : c'est la forme la moins énergétique et donc la plus stable;
La forme simple de la molécule est qualifiée de monomère (MB+).
L'agrégation des molécules de colorant en solution se fait de manière instantanée sous forme d’agrégats-H lorsqu’elles sont au voisinage des particules colloïdales d'argile de type montmorillonite (en présence des doubles couches électriques à la surface des argiles) (Bujdák et al., 1998[15]; 2002[16]).
Pour les montmorillonites faiblement chargées (avec une charge structurale proche de 0,2 ou une faible CEC de l'ordre de 70-80 meq/100g), les agrégats moléculaires initialement formés à la surface de l'argile évoluent avec le temps vers une désagrégation. Cette décomposition des agrégats se produit lentement pendant des heures ou des jours, pendant ou après l'adsorption du colorant sur la surface des particules argileuses (Bujdák et al., 2002[16]).
On assiste donc à une réorganisation des molécules de bleu avec le temps à la surface de l’argile avec une possibilité de diffusion lente dans les espaces inter-feuillets. Aussi selon la vitesse à laquelle les mesures de la valeur de bleu sont réalisées, ce sont généralement des agrégats de molécules de bleu qui sont présents à la surface. Quant aux argiles avec une forte densité de charge (comme les montmorillonites avec une forte CEC autour de 100 -120 meq/100g), les agrégats-H formés initialement en solution restent stables après leur formation.
Les phénomènes à la surface de l’argile vont également dépendre de la concentration de MB dans la solution. Pour les fortes concentrations en MB, les agrégats sont favorisés alors que pour les faibles concentrations, ce sont les monomères et dimères qui sont présents. Le fait de réaliser l’adsorption par ajout successifs de doses de solution de bleu de méthylène permet de rester à faible concentration. Un test en mettant en contact l’argile avec une solution concentrée de bleu puis de doser le bleu restant en solution après centrifugation peut conduire à favoriser l’agrégation des molécules.
Pour les montmorillonites à forte charge structurale
- la capacité d'adsorption de MB est forte avec une forte énergie d'agrégation ;
- la forme de l'agrégat est celle de l'agrégat-H et leur forme reste stable après leur formation à la surface des argiles ;
- l'arrangement des molécules de MB est ordonné avec un fort angle d'inclinaisons par rapport à la surface basale des feuillets argileux ;
Pour les montmorillonites à faible charge structurale
- la capacité d'adsorption de MB est faible avec une faible énergie d'agrégation ;
- la forme de l'agrégat est celle d'un monomère isolé voire de dimère et d'agrégat-J qui résultent de la désagrégation des agrégat-H ;
- l'arrangement des molécules de MB est désordonné, en amas inclinés perpendiculaires, avec un faible angle d'inclinaisons par rapport à la surface basale des feuillets argileux ;
Pour les illites
Pour les kaolinites
De manière simplifiée, cette aptitude variable pour la particule de bleu à se fixer sur les argiles peut conduire à des résultats quantitatifs très différents selon la minéralogie des particules : ainsi, une illite présentant une forte charge structurale et un nombre moyens de feuillets TOT par particules primaires, peut fixer autant de molécules de bleu qu'une montmorillonite fortement chargée. De même, une kaolinite avec une faible charge structurale et un nombre élevé de feuillets TO par particules primaires peut être équivalente en bleu à une montmorillonite faiblement chargée.
Préparation de la solution de bleu de méthylène
Selon l'annexe A de la norme NF P94-068[1] (et presque en tout point identique à l'annexe C de la norme NF EN 933-9[2] pour l'essai des granulats), la préparation doit être réalisée très précisément selon le protocole suivant :
- Utiliser de l'eau déminéralisée ou distillée.
- Utiliser du bleu de méthylène, de qualité pharmaceutique référence CODEX, degré de pureté ≥ 98,5 %, présenté sous forme de poudre et conditionné en flacon.
- Déterminer la teneur en eau de la poudre de bleu de méthylène contenue dans le flacon, sur un échantillon d'environ 5 g ; la teneur en eau doit être déterminée pour la préparation de chaque nouvelle solution de bleu.
- Verser 500 g à 700 g d'eau déminéralisée ou distillée dans le récipient. Si on utilise de l'eau chaude la température ne doit pas excéder 50 °C (40°C pour la norme NF EN 933-9[2]) ;
- Prendre une masse de poudre de bleu de méthylène de (10 (1 + w) ± 0,01) g soit l'équivalent de 10 g de poudre sèche ;
- Agiter le contenu du récipient en ajoutant lentement la poudre de bleu de méthylène dans l'eau. Vérifier la complète dissolution de la poudre et si elle n'est pas atteinte poursuivre l'agitation ;
- Compléter la masse de la solution avec de l'eau déminéralisée ou distillée jusqu'à une masse totale de solution de (1 000 ± 5) g puis agiter la solution pendant au moins 5 min. Dans le cas où on utilise une fiole jaugée de 1 litre, compléter avec de l'eau déminéralisée ou distillée jusqu'au trait repère en s'assurant que la température de la solution soit proche de (20 ± 1) °C ;
- Conserver la solution ainsi préparée dans une bouteille de conservation fermée (en verre teinté de préférence) et placée à l'abri de la lumière. La solution de bleu de méthylène ne doit pas être utilisée plus d'un mois après sa préparation (28 jours dans la norme NF EN 933-9[2]).
Les indications suivantes doivent figurer sur la bouteille de conservation :
- nature du contenu : solution de bleu de méthylène à 10 g/l ;
- date de préparation : ................................................ ;
- date limite d'utilisation : ........................................... ;
La solution périmée peut être évacuée dans le tout-à-l'égout car elle ne présente aucune nocivité pour l'environnement. Elle présente néanmoins l'inconvénient de fortement tacher les surfaces. Frotter avec une poudre à récurer javellisée permet un bon nettoyage.
References
- ↑ 1,0 et 1,1 AFNOR. 1998. NF P94-068. Sols : reconnaissance et essais - Mesure de la capacité d'adsorption de bleu de méthylène d'un sol ou d'un matériau rocheux - Détermination de la valeur de bleu de méthylène d'un sol ou d'un matériau rocheux par l'essai à la tache.
- ↑ 2,0, 2,1, 2,2 et 2,3 AFNOR. 2013. NF EN 933-9+A1. Essai pour déterminer les caractéristiques géométriques des granulats - Partie 9 : qualification des fines - Essai au bleu de méthylène
- ↑ TRAN NGOC LAN (1977): Un nouvel essai d'identification des sols: l'essai au bleu de méthylène.Bull. Liaison. Labo. P. et Ch. no 88, p. 136–137.
- ↑ TRAN NGOC LAN. 1979. L'essai au bleu de méthylène. Avant-projet de mode opératoire. Ministère de l'Environment et du Cadre de vie, L.C.P.C., Département géotechnique.
- ↑ TRAN NGOC LAN (1980): L'essai au bleu de méthylène. Un progrès dans la mesure et le contrôle de la propreté des granulats.Bull. Liaison Labo. P. et Ch., no 107, p. 130–135.
- ↑ TRAN NGOC LAN (1981): Utilisation de l'essai au bleu de méthylène en terrassement routier.Bull. Liaison Labo. P. et Ch., no 111, p. 5–16.
- ↑ Dyal R.S.; Hendricks S.B. Total Surface of Clays in Polar Liquids as a Characteristic Index. J. Soil Sci. 1950, 59, 421-432
- ↑ 8,0 et 8,1 Pham T.H; Brindley G.W. Methlylene Blue Adsorption by Clay Minerals. Determination of Surface Areas and Cation Exchange Capacities. Clays and Clay Minerals 1970, 18, 203-212
- ↑ Kaneko Y.; Iyi N.; Bujdak J.; Sasai R.; Fujita T. Molecular Orientation of Methylene Blue Intercalated in Layer-Charge-Controlled Montmorillonites. J. Mater. Res. 2003, 18, 2639-2643
- ↑ Kobayashi T. J-Aggregates. In World Scientific; 1996
- ↑ 11,0, 11,1 et 11,2 Bujdak J.; Lyi N.; Kaneko Y.; Sasai R. Molecular Orientation of Methylene Blue Cations Adsorbed on Clay Surfaces. Clay Minerals 2003, 38, 561-572
- ↑ Umemura Y. Preparation of Methylene Blue-Clay Hybrid Films by a Modified Langmuir-Blodgett Method and Molecular Orientation of Methylene Blue in the Film. Nendo-Kagaku (Journal of the Clay Sciences Society of Japan) 2003, 42, 218-222.
- ↑ Bujdak J.; Czímerová A.; lyi N. Structure of Cationic Dyes Assemblies Intercalated in the Films oMontmorillonite. Thin Solid Films. 2008, 517, 793-799.
- ↑ Hähner G.; Marti, A.; Spencer N. D.; Caseri W. R. Orientation and Electronic Structure of Methylene Blue on Mica: a Near Edge X-Ray Absorption Structure Spectroscopic Study. The Journal of Physical Chemistry 1996, 104, 7749-7757.
- ↑ Bujdak J.; Janek M.; Madejova J.; Komadel P. Influence of the Layer Charge Density of Smectites on the Interaction With Methylene Blue. J Chem Soc. 1998, 94, 3487-3492
- ↑ 16,0 et 16,1 Bujdak J.; Lyi N.; Fujita T. The Aggregation of Methylene Blue in Montmorillonite Dispersions. Clay Minerals 2002, 37, 121-133
 S'abonner à un flux RSS
S'abonner à un flux RSS