Cuivre (HU) : Différence entre versions
(→Impacts possibles sur la santé) |
|||
| (14 révisions intermédiaires par un utilisateur sont masquées) | |||
| Ligne 1 : | Ligne 1 : | ||
''<u>Traduction anglaise</u> : Copper'' | ''<u>Traduction anglaise</u> : Copper'' | ||
| − | <u>Dernière mise à jour</u> : | + | <u>Dernière mise à jour</u> : 05/09/2022 |
| − | Métal de numéro atomique 29 appartenant à la même famille que l’argent et l’or. | + | Métal de symbole Cu et de numéro atomique 29 appartenant à la même famille que l’argent et l’or et présentant une très grande conductivité thermique et électrique ; les sels solubles de cuivre sont toxiques ce qui justifie son classement parmi les [[Métaux lourds (HU)|métaux lourds]]. |
| − | == | + | ==Nature et différentes formes physico-chimiques== |
| − | + | Le cuivre est relativement abondant dans la couche terrestre. On le trouve principalement sous la forme de sulfure ou de sulfo-sels. Il s'agit également de l'un des rares métaux que l'on trouve à l'état natif dans la nature. Cette présence à l'état natif, associée à sa basse température de fusion et à sa couleur rouge, expliquent pourquoi le cuivre a été l'un des premiers métaux travaillés par l’Homme, ceci dès la première moitié du Vème millénaire avant J.-C. Les alliages de cuivre (principalement avec de l'étain) ont été à l'origine d'une révolution technologique 2.300 ans avant notre ère : l'âge du bronze. Le cuivre a depuis été beaucoup utilisé, ceci à toutes les époques, pour bénéficier de sa ductilité, de sa malléabilité et de sa très bonne conductivité. L'association internationale du cuivre (https://copperalliance.org/fr/sustainable-copper/about-copper/) estime qu'en 2019 : | |
| + | * la masse annuelle de cuivre extraite a été de l'ordre de 21 millions de tonnes ; | ||
| + | * la masse annuelle produite a été de l'ordre de 29 millions de tonnes (la différence de 8 millions de tonnes provenant du recyclage) ; | ||
| + | * la masse de cuivre dans des objets en circulation est d'environ 500 millions de tonnes. | ||
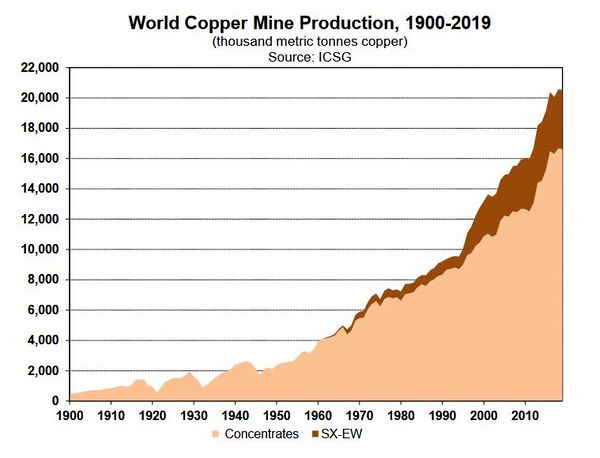
| − | + | La production augmente régulièrement d'environ 3,6% par an depuis un siècle, le principal producteur de minerai étant le Chili (''figure 1'') et le principal producteur de métal raffiné étant la Chine (ICSG, 2020). | |
| − | |||
| − | + | [[File:cuivre_evolution_production.JPG|600px|center|thumb|<center>''<u>Figure 1</u> : Évolution de la production mondiale de cuivre depuis 1900 ; <u>Source</u> : ICSG, 2020.''</center>]] | |
| − | Le cuivre est | + | Le cuivre est donc très présent dans l'environnement sous la forme métallique. On le trouve également sous deux états principaux d'oxydation : |
| + | * le cuivre I : Cu<sup>+</sup> (sels qualifiés de cuivreux) ; | ||
| + | * le cuivre II : Cu<sup>2+</sup> (sels qualifiés de cuivriques), état le plus fréquent ; les sels cuivrique les plus connus sont le carbonate de cuivre qui donne une patine grise caractéristique aux toitures des monuments anciens (le chlorure de cuivre qui se forme en milieu marin a le même aspect) et le sulfate de cuivre utilisé comme [[Fongicide (HU)|fongicide]] dans la bouillie bordelaise. | ||
| − | + | <u>Nota</u> : Dans la vie courante, on donne souvent aux différents oxydes cuivriques (carbonate de cuivre, chlorure de cuivre, acétate de cuivre) qui partagent la même couleur gris-vert l'appellation vert-de-gris. | |
| − | Les | + | Le cuivre métallique est insoluble dans l'eau, en revanche les différents oxydes présentent une petite solubilité. L'essentiel de ces sels est cependant fixé sur les particules (voir le § sur la toxicité). |
| + | |||
| + | ==Sources et concentrations moyennes== | ||
| + | |||
| + | ===Différentes sources de cuivre dans l'environnement=== | ||
| + | |||
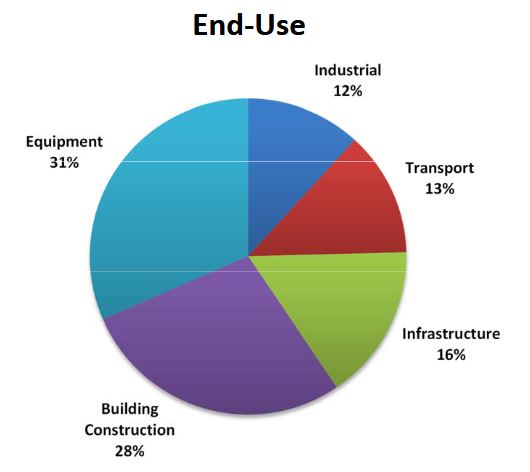
| + | Le cuivre est utilisé dans un grand nombre de domaines (''figure 2''). | ||
| + | |||
| + | |||
| + | [[File:cuivre_utilisation.JPG|600px|center|thumb|<center>''<u>Figure 2</u> : Utilisation du cuivre par domaine ; <u>Source</u> : ICSG, 2020.''</center>]] | ||
| + | |||
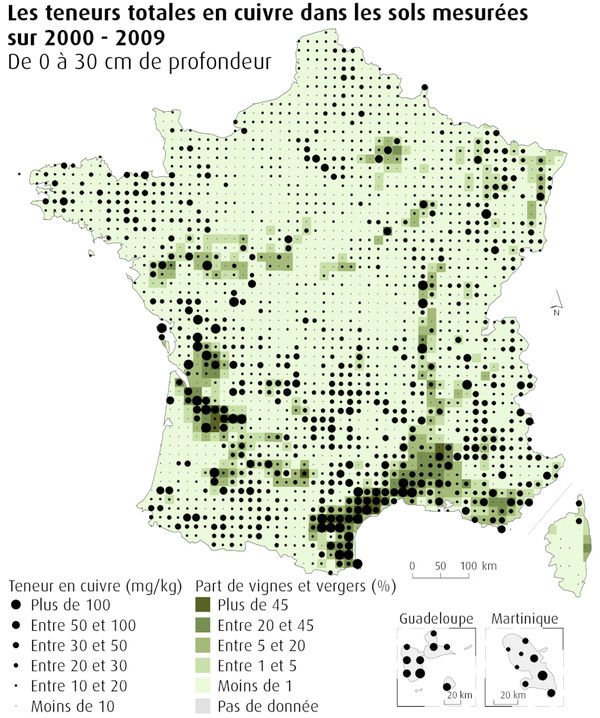
| + | Cependant l'importance relative des sources de cuivre dans l'environnement est très différente de celle des domaines d'utilisation. Alors que seulement 2 % de la production de cuivre sert à la production de composés chimiques. Ces derniers sont responsables de l'essentiel des apports dans les sols et dans l'eau. Par exemple 53 % des sols ayant les plus fortes teneurs (plus de 100 mg/kg) se trouvent dans des zones occupées à plus de 20 % par des vignes et des vergers (''figure 3''). Ces fortes teneurs résultent des traitements [[Fongicide (HU)|fongicides]] récurrents, à base de sulfates de cuivre (bouillie bordelaise) (CGDD, 2019). | ||
| + | |||
| + | |||
| + | [[File:cuivre_dcpc_la_contamination_par_les_metaux_carte5_cuivre_2.jpg|600px|center|thumb|<center>''<u>Figure 3</u> : Teneurs en cuivre dans les sols et présence de vignes et vergers ; <u>Source</u> : CGDD, 2019.''</center>]] | ||
| + | |||
| + | L'utilisation de peintures antifouling utilisant du cuivre et l'érosion des sols pollués est responsable d'une partie importante de la présence de cuivre dans les milieux aquatiques. Les autres sources sont l'érosion et l'abrasion des matériaux utilisés dans le bâtiment (principalement des toitures) et l'usure des pièces des véhicules (principalement plaquettes de frein et pneus) (voir § suivant). | ||
| + | |||
| + | ===Contribution des rejets d'assainissement=== | ||
| + | |||
| + | Les concentrations en cuivre dans les [[Rejet urbain de temps de pluie / RUTP (HU)|rejets urbains de temps de pluie]] sont en général comprises entre 10 et 100 μg/L (Al-Juhaishi, 2018, Becouze-Lareure, 2010, Dembélé, 2010, Dutordoir, 2014, Gromaire, 2012, Moilleron, 2004, Zgheib, 2009). Elles sont du même ordre de grandeur que celles trouvées dans les eaux usées en entrée de station d'épuration mais 10 fois supérieures à celles trouvées dans les rejets de ces même stations (Coquery ''et al'', 2011). | ||
| + | |||
| + | <u>Nota</u> : les concentrations indiquées sont des ordres de grandeur car les valeurs observées sont très variables d'un site à un autre et d'un événement à un autre. | ||
| + | |||
| + | Coquery ''et al'' (2011) évaluent ainsi la masse rejetée par les stations d'épuration à 10g/j/hab, soient 600 à 700 tonnes par an en France. La masse contenue dans les rejets urbains de temps de pluie est probablement du même ordre de grandeur. Le cuivre est également distribué entre les phases particulaire et dissoute dans les [[Eau de ruissellement (HU)|eaux de ruissellement]]. La part fixée sur les [[Matières en suspension / MES (HU)|matières en suspension]] augmente au fur et à mesure que l'on progresse dans le système d'assainissement, depuis l'amont vers l'aval. Elle est en général de l'ordre de 80% au moment du rejet, voisine de celle que l'on trouve dans les eaux usées brutes. | ||
| + | |||
| + | Les apports par les [[Boue (HU)|boues]] de station d'épuration ne sont pas non plus à négliger. Les concentrations moyennes dans les boues sont de l'ordre de 100 à 1000 mg/kg de matières sèches (Coquery ''et al'', 2011) à comparer aux teneurs moyennes observés dans les sols de surface qui vont 1 à 508 mg/kg (figure 3). Elles sont cependant presque toujours inférieures à la concentration limite de référence pour la [[Valorisation des boues (HU)|valorisation agricole des boues]] de station d'épuration qui est fixée à 1000 mg/kg de matière sèche par la norme NF U 44-041. | ||
| + | |||
| + | ==Toxicité et danger associés== | ||
| + | |||
| + | ===Impacts possibles sur la santé=== | ||
| + | |||
| + | Le cuivre est un oligo-élément nécessaire à certaines réactions enzimatiques. Le corps humain contient environ 150 mg de cuivre sous diverses formes et les besoins quotidiens sont de l'ordre de 2 mg pour une personne de 75 kg. Une insuffisance en cuivre peut se manifester par des troubles de la croissance et une perte de poids. A l'opposé un excès de cuivre peut provoquer une inflammation du foie ainsi que différentes réactions allergiques. Les quantités nécessaires (plus de 35 mg par jour durant une longue période) sont cependant importantes et les intoxications sont rares. Les sels de cuivre dissous présentent une toxicité plus grande que la forme métallique([https://solidarites-sante.gouv.fr/IMG/pdf/Tableau_Toxicite_des_metaux_et_des_metalloides_sous_leurs_differentes_formes_chimiques_.pdf Toxicité des métaux et de leurs différentes formes]). Un effet [[Réprotoxique (HU)|réprotoxique]] est suspecté, aucun effet cancérigène n'a été mis en évidence. | ||
| + | |||
| + | La limite de concentration pour l'[[Eau destinée à la consommation humaine (HU)|eau destinée à la consommation humaine]] est de 2 mg/L. | ||
| + | |||
| + | ===Impacts possibles sur les milieux aquatiques=== | ||
| + | |||
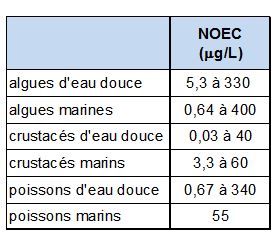
| + | La majorité du cuivre rejeté dans l’eau est sous forme particulaire et tend à se déposer, à précipiter ou à s’[[Adsorption (HU)|adsorber]] à la matière organique, au fer hydraté, aux oxydes de manganèse ou aux argiles (Bisson ''et al'', 2019). Au contraire, dans la phase soluble, la [[Biodisponibilité (HU)|biodisponibilité]] et la toxicité du cuivre peuvent être favorisées par des molécules complexantes organiques synergiques qui sont liposolubles et par conséquent capables de traverser les membranes cellulaires (Ellis ''et al'', 2004). Le cuivre a tendance de se bio-accumuler, principalement chez les poissons. La [[Bioaccumulation (HU)|bioaccumulation]] est cependant très dépendante des concentrations d’exposition et de différentes caractéristiques du milieu, en particulier du [[PH (HU)|pH]] et de la dureté de l'eau. Les poissons d'eau douce tolèrent par exemple une concentration en cuivre dissous de 112 μg/L si la dureté de l'eau dépasse 100 mg/L de CaC0<sub>3</sub> tandis que si la dureté est inférieure à 10 mg/L la concentration ne doit pas dépasser 5 μg/L. Ces éléments explique la grande variabilité des valeurs de concentration sans effet observable (NOEC) que l'on trouve dans la littérature (Bisson ''et al'', 2019) et ''figure 4''. | ||
| + | |||
| + | |||
| + | [[File:cuivre_noec_ineris.JPG|600px|center|thumb|<center>''<u>Figure 4</u> : Différentes valeurs de concentration sans effet observable (No Observable Effect Concentration) trouvées dans la littérature ; <u>Source</u> : Bisson''et al.'', 2019.''</center>]] | ||
| + | |||
| + | La valeur retenue par l'[https://www.legifrance.gouv.fr/jorf/id/JORFTEXT000031107256 arrêté du 27 juillet 2015] comme [[Norme de qualité environnementale / NQE (HU)|Norme de Qualité Environnementale (NQE)]] pour les eaux douces de surface est de 1 μg/L en moyenne annuelle. | ||
| + | |||
| + | <u>Bibliographie </u> : | ||
| + | * Al-Juhaishi, M.R.D. (2018) : Caractérisation et impact de la pollution dans les rejets urbains par temps de pluie (RUTP) sur des bassins versants de l'agglomération Orléanaise ; Thèse de doctorat, Institut des Sciences de la terre d'Orléans, 210p. | ||
| + | * Baize, D., Courbe, C., Suc, O., Schwartz, C., Tercé, M., Bispo, A., Sterckman, T., Ciesielski, H. (2006) : Épandages de boues d’épuration urbaines sur des terres agricoles : impacts sur la composition en éléments en traces des sols et des grains de blé tendre ; Courrier de l’environnement de l’INRA n°53, décembre 2006 ; téléchargeable sur : https://hal.archives-ouvertes.fr/hal-01199208/file/C53Baize.pdf | ||
| + | * Becouze-Lareure, C. (2010) : Caractérisation et estimation des flux de substances prioritaires dans les rejets urbains par temps de pluie sur deux bassins versants expérimentaux. Thèse de doctorat, INSA-Lyon, laboratoire DEEP, 298 p. | ||
| + | * Coquery M., Pomiès M., Martin-Ruel S., Budzinski H., Miège C., Esperanza M., Soulier C., Choubert J.-M.(2011) : Mesurer les micropolluants dans les eaux brutes et traitées - Protocoles et résultats pour l'analyse des concentrations et des flux ; Techniques Sciences et Méthodes, 1/2 : 25-43 ; disponible sur : [http://projetamperes.cemagref.fr/illustrations/25-43-COQUERY.pdf projetamperes.cemagref.fr] | ||
| + | * CGDD (2019) : La contamination des sols par les métaux ; Conseil Général au Développement Durable ; disponbible sur : [https://www.notre-environnement.gouv.fr/rapport-sur-l-etat-de-l-environnement/themes-ree/risques-nuisances-pollutions/pollution-des-sols/contamination-des-sols/article/la-contamination-des-sols-par-les-metaux?lien-ressource=5192&ancreretour=lireplus www.notre-environnement.gouv.fr] | ||
| + | * Dembélé, A. (2010) : MES, DCO et polluants prioritaires des rejets urbains de temps de pluie : mesure et modélisation des flux événementiels, Thèse de doctorat, INSA Lyon, DEEP. | ||
| + | * Desportes I. (coord.) (2007) : Bilan des flux de contaminants entrant sur les sols agricoles de France métropolitaine ; étude ADEME-SOGREAH ; rapport final ; 330p. ; disponible sur le [https://librairie.ademe.fr/sols-pollues/3611-bilan-des-flux-de-contaminants-entrant-sur-les-sols-agricoles-de-france-metropolitaine.html site de l'ADEME]. | ||
| + | * Dutordoir, S. (2014) : Bilan des flux de métaux, carbone organique et nutriments contenus dans une rivière alpine : part des rejets urbains de l‘agglomération de Grenoble et apports amont (Isère et Drac). | ||
| + | * Ellis, B., Chocat, B., Fujita, S., Rauch, W., Marsalek, J. (2004) : Urban drainage, a multilingual glossary ; IWA publishing ; 512p. | ||
| + | * Gromaire, M.-C. (2012) : Contribution à l’étude des sources et flux de contaminants dans les eaux pluviales urbaines. Mémoire HDR, Université Paris Est, 107p. | ||
| + | * ICSG (2020) : The world copper factbook 2020 ; International copper study group ; 67p. ; disponible sur : [https://copperalliance.org/wp-content/uploads/2021/01/2020_10_13_ICSG_Factbook_2020.pdf copperalliance.org] | ||
| + | * Moilleron, R. (2004) - Hydrocarbures et métaux en milieu urbain. Mémoire HDR, 79 p. | ||
| + | |||
| + | <u>Pour en savoir plus</u> : | ||
| + | * Bisson, M., Boulevert, E., Marlière, M., Oberson Geneste, D. (2019) : Le cuivre et ses composés ; fiche de données toxicologiques et environnementales ; INERIS ; 85p. ; disponible sur le [https://substances.ineris.fr/fr/ Portail substances chimiques de l'INERIS]. | ||
[[Catégorie:Dictionnaire_DEHUA]] | [[Catégorie:Dictionnaire_DEHUA]] | ||
| + | [[Catégorie:Métaux_et_pollution_métallique_(HU)]] | ||
Version actuelle en date du 7 septembre 2022 à 14:43
Traduction anglaise : Copper
Dernière mise à jour : 05/09/2022
Métal de symbole Cu et de numéro atomique 29 appartenant à la même famille que l’argent et l’or et présentant une très grande conductivité thermique et électrique ; les sels solubles de cuivre sont toxiques ce qui justifie son classement parmi les métaux lourds.
Sommaire |
[modifier] Nature et différentes formes physico-chimiques
Le cuivre est relativement abondant dans la couche terrestre. On le trouve principalement sous la forme de sulfure ou de sulfo-sels. Il s'agit également de l'un des rares métaux que l'on trouve à l'état natif dans la nature. Cette présence à l'état natif, associée à sa basse température de fusion et à sa couleur rouge, expliquent pourquoi le cuivre a été l'un des premiers métaux travaillés par l’Homme, ceci dès la première moitié du Vème millénaire avant J.-C. Les alliages de cuivre (principalement avec de l'étain) ont été à l'origine d'une révolution technologique 2.300 ans avant notre ère : l'âge du bronze. Le cuivre a depuis été beaucoup utilisé, ceci à toutes les époques, pour bénéficier de sa ductilité, de sa malléabilité et de sa très bonne conductivité. L'association internationale du cuivre (https://copperalliance.org/fr/sustainable-copper/about-copper/) estime qu'en 2019 :
- la masse annuelle de cuivre extraite a été de l'ordre de 21 millions de tonnes ;
- la masse annuelle produite a été de l'ordre de 29 millions de tonnes (la différence de 8 millions de tonnes provenant du recyclage) ;
- la masse de cuivre dans des objets en circulation est d'environ 500 millions de tonnes.
La production augmente régulièrement d'environ 3,6% par an depuis un siècle, le principal producteur de minerai étant le Chili (figure 1) et le principal producteur de métal raffiné étant la Chine (ICSG, 2020).
Le cuivre est donc très présent dans l'environnement sous la forme métallique. On le trouve également sous deux états principaux d'oxydation :
- le cuivre I : Cu+ (sels qualifiés de cuivreux) ;
- le cuivre II : Cu2+ (sels qualifiés de cuivriques), état le plus fréquent ; les sels cuivrique les plus connus sont le carbonate de cuivre qui donne une patine grise caractéristique aux toitures des monuments anciens (le chlorure de cuivre qui se forme en milieu marin a le même aspect) et le sulfate de cuivre utilisé comme fongicide dans la bouillie bordelaise.
Nota : Dans la vie courante, on donne souvent aux différents oxydes cuivriques (carbonate de cuivre, chlorure de cuivre, acétate de cuivre) qui partagent la même couleur gris-vert l'appellation vert-de-gris.
Le cuivre métallique est insoluble dans l'eau, en revanche les différents oxydes présentent une petite solubilité. L'essentiel de ces sels est cependant fixé sur les particules (voir le § sur la toxicité).
[modifier] Sources et concentrations moyennes
[modifier] Différentes sources de cuivre dans l'environnement
Le cuivre est utilisé dans un grand nombre de domaines (figure 2).
Cependant l'importance relative des sources de cuivre dans l'environnement est très différente de celle des domaines d'utilisation. Alors que seulement 2 % de la production de cuivre sert à la production de composés chimiques. Ces derniers sont responsables de l'essentiel des apports dans les sols et dans l'eau. Par exemple 53 % des sols ayant les plus fortes teneurs (plus de 100 mg/kg) se trouvent dans des zones occupées à plus de 20 % par des vignes et des vergers (figure 3). Ces fortes teneurs résultent des traitements fongicides récurrents, à base de sulfates de cuivre (bouillie bordelaise) (CGDD, 2019).
L'utilisation de peintures antifouling utilisant du cuivre et l'érosion des sols pollués est responsable d'une partie importante de la présence de cuivre dans les milieux aquatiques. Les autres sources sont l'érosion et l'abrasion des matériaux utilisés dans le bâtiment (principalement des toitures) et l'usure des pièces des véhicules (principalement plaquettes de frein et pneus) (voir § suivant).
[modifier] Contribution des rejets d'assainissement
Les concentrations en cuivre dans les rejets urbains de temps de pluie sont en général comprises entre 10 et 100 μg/L (Al-Juhaishi, 2018, Becouze-Lareure, 2010, Dembélé, 2010, Dutordoir, 2014, Gromaire, 2012, Moilleron, 2004, Zgheib, 2009). Elles sont du même ordre de grandeur que celles trouvées dans les eaux usées en entrée de station d'épuration mais 10 fois supérieures à celles trouvées dans les rejets de ces même stations (Coquery et al, 2011).
Nota : les concentrations indiquées sont des ordres de grandeur car les valeurs observées sont très variables d'un site à un autre et d'un événement à un autre.
Coquery et al (2011) évaluent ainsi la masse rejetée par les stations d'épuration à 10g/j/hab, soient 600 à 700 tonnes par an en France. La masse contenue dans les rejets urbains de temps de pluie est probablement du même ordre de grandeur. Le cuivre est également distribué entre les phases particulaire et dissoute dans les eaux de ruissellement. La part fixée sur les matières en suspension augmente au fur et à mesure que l'on progresse dans le système d'assainissement, depuis l'amont vers l'aval. Elle est en général de l'ordre de 80% au moment du rejet, voisine de celle que l'on trouve dans les eaux usées brutes.
Les apports par les boues de station d'épuration ne sont pas non plus à négliger. Les concentrations moyennes dans les boues sont de l'ordre de 100 à 1000 mg/kg de matières sèches (Coquery et al, 2011) à comparer aux teneurs moyennes observés dans les sols de surface qui vont 1 à 508 mg/kg (figure 3). Elles sont cependant presque toujours inférieures à la concentration limite de référence pour la valorisation agricole des boues de station d'épuration qui est fixée à 1000 mg/kg de matière sèche par la norme NF U 44-041.
[modifier] Toxicité et danger associés
[modifier] Impacts possibles sur la santé
Le cuivre est un oligo-élément nécessaire à certaines réactions enzimatiques. Le corps humain contient environ 150 mg de cuivre sous diverses formes et les besoins quotidiens sont de l'ordre de 2 mg pour une personne de 75 kg. Une insuffisance en cuivre peut se manifester par des troubles de la croissance et une perte de poids. A l'opposé un excès de cuivre peut provoquer une inflammation du foie ainsi que différentes réactions allergiques. Les quantités nécessaires (plus de 35 mg par jour durant une longue période) sont cependant importantes et les intoxications sont rares. Les sels de cuivre dissous présentent une toxicité plus grande que la forme métallique(Toxicité des métaux et de leurs différentes formes). Un effet réprotoxique est suspecté, aucun effet cancérigène n'a été mis en évidence.
La limite de concentration pour l'eau destinée à la consommation humaine est de 2 mg/L.
[modifier] Impacts possibles sur les milieux aquatiques
La majorité du cuivre rejeté dans l’eau est sous forme particulaire et tend à se déposer, à précipiter ou à s’adsorber à la matière organique, au fer hydraté, aux oxydes de manganèse ou aux argiles (Bisson et al, 2019). Au contraire, dans la phase soluble, la biodisponibilité et la toxicité du cuivre peuvent être favorisées par des molécules complexantes organiques synergiques qui sont liposolubles et par conséquent capables de traverser les membranes cellulaires (Ellis et al, 2004). Le cuivre a tendance de se bio-accumuler, principalement chez les poissons. La bioaccumulation est cependant très dépendante des concentrations d’exposition et de différentes caractéristiques du milieu, en particulier du pH et de la dureté de l'eau. Les poissons d'eau douce tolèrent par exemple une concentration en cuivre dissous de 112 μg/L si la dureté de l'eau dépasse 100 mg/L de CaC03 tandis que si la dureté est inférieure à 10 mg/L la concentration ne doit pas dépasser 5 μg/L. Ces éléments explique la grande variabilité des valeurs de concentration sans effet observable (NOEC) que l'on trouve dans la littérature (Bisson et al, 2019) et figure 4.
La valeur retenue par l'arrêté du 27 juillet 2015 comme Norme de Qualité Environnementale (NQE) pour les eaux douces de surface est de 1 μg/L en moyenne annuelle.
Bibliographie :
- Al-Juhaishi, M.R.D. (2018) : Caractérisation et impact de la pollution dans les rejets urbains par temps de pluie (RUTP) sur des bassins versants de l'agglomération Orléanaise ; Thèse de doctorat, Institut des Sciences de la terre d'Orléans, 210p.
- Baize, D., Courbe, C., Suc, O., Schwartz, C., Tercé, M., Bispo, A., Sterckman, T., Ciesielski, H. (2006) : Épandages de boues d’épuration urbaines sur des terres agricoles : impacts sur la composition en éléments en traces des sols et des grains de blé tendre ; Courrier de l’environnement de l’INRA n°53, décembre 2006 ; téléchargeable sur : https://hal.archives-ouvertes.fr/hal-01199208/file/C53Baize.pdf
- Becouze-Lareure, C. (2010) : Caractérisation et estimation des flux de substances prioritaires dans les rejets urbains par temps de pluie sur deux bassins versants expérimentaux. Thèse de doctorat, INSA-Lyon, laboratoire DEEP, 298 p.
- Coquery M., Pomiès M., Martin-Ruel S., Budzinski H., Miège C., Esperanza M., Soulier C., Choubert J.-M.(2011) : Mesurer les micropolluants dans les eaux brutes et traitées - Protocoles et résultats pour l'analyse des concentrations et des flux ; Techniques Sciences et Méthodes, 1/2 : 25-43 ; disponible sur : projetamperes.cemagref.fr
- CGDD (2019) : La contamination des sols par les métaux ; Conseil Général au Développement Durable ; disponbible sur : www.notre-environnement.gouv.fr
- Dembélé, A. (2010) : MES, DCO et polluants prioritaires des rejets urbains de temps de pluie : mesure et modélisation des flux événementiels, Thèse de doctorat, INSA Lyon, DEEP.
- Desportes I. (coord.) (2007) : Bilan des flux de contaminants entrant sur les sols agricoles de France métropolitaine ; étude ADEME-SOGREAH ; rapport final ; 330p. ; disponible sur le site de l'ADEME.
- Dutordoir, S. (2014) : Bilan des flux de métaux, carbone organique et nutriments contenus dans une rivière alpine : part des rejets urbains de l‘agglomération de Grenoble et apports amont (Isère et Drac).
- Ellis, B., Chocat, B., Fujita, S., Rauch, W., Marsalek, J. (2004) : Urban drainage, a multilingual glossary ; IWA publishing ; 512p.
- Gromaire, M.-C. (2012) : Contribution à l’étude des sources et flux de contaminants dans les eaux pluviales urbaines. Mémoire HDR, Université Paris Est, 107p.
- ICSG (2020) : The world copper factbook 2020 ; International copper study group ; 67p. ; disponible sur : copperalliance.org
- Moilleron, R. (2004) - Hydrocarbures et métaux en milieu urbain. Mémoire HDR, 79 p.
Pour en savoir plus :
- Bisson, M., Boulevert, E., Marlière, M., Oberson Geneste, D. (2019) : Le cuivre et ses composés ; fiche de données toxicologiques et environnementales ; INERIS ; 85p. ; disponible sur le Portail substances chimiques de l'INERIS.
 S'abonner à un flux RSS
S'abonner à un flux RSS