Oxydoréduction (HU) : Différence entre versions
(→Équilibre des réactions d'oxydoréduction) |
|||
| (Une révision intermédiaire par un utilisateur est masquée) | |||
| Ligne 1 : | Ligne 1 : | ||
''<u>Traduction anglaise</u> : Oxydation-reduction'' | ''<u>Traduction anglaise</u> : Oxydation-reduction'' | ||
| − | <u>Dernière mise à jour</u> : | + | <u>Dernière mise à jour</u> : 15/04/2025 |
Réaction chimique dans laquelle des électrons sont échangés par un couple oxydant/réducteur, le composé oxydant acceptant les électrons cédés par le composé réducteur. | Réaction chimique dans laquelle des électrons sont échangés par un couple oxydant/réducteur, le composé oxydant acceptant les électrons cédés par le composé réducteur. | ||
| Ligne 26 : | Ligne 26 : | ||
| − | <center><math>n_2.Oxydant_1 + n_1Réducteur_2 \rightarrow n_2.Réducteur_1 + | + | <center><math>n_2.Oxydant_1 + n_1Réducteur_2 \rightarrow n_2.Réducteur_1 + n_1.Oxydant_2</math></center> |
Exemple : | Exemple : | ||
Version actuelle en date du 15 avril 2025 à 09:24
Traduction anglaise : Oxydation-reduction
Dernière mise à jour : 15/04/2025
Réaction chimique dans laquelle des électrons sont échangés par un couple oxydant/réducteur, le composé oxydant acceptant les électrons cédés par le composé réducteur.
L'oxygène, par exemple, est un composé oxydant puissant mis en jeu dans de très nombreuses réactions en milieu aqueux. Voir Oxydation.
Un couple oxydant/réducteur est défini par une demi-équation chimique non équilibrée en électrons :
[modifier] Équilibre des réactions d'oxydoréduction
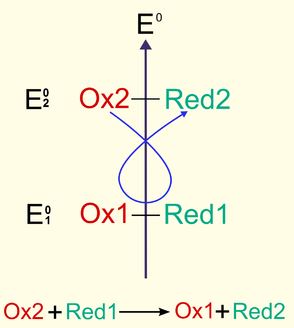
Une réaction d'oxydoréduction fait intervenir deux couples oxydant / réducteur, afin que les échanges d'électrons soient équilibrés. L'oxydant le plus fort (oxydant 1) réagit avec le réducteur le plus fort (réducteur 2) des deux couples, et les deux demi-réactions :
se composent pour donner la réaction globale :
Exemple :
Donnent la réaction globale :
L'oxydant 1 ($ Ce^{4+} $) a été réduit à l'état ($ Ce^{3+} $), tandis que le réducteur 2 ($ Fe^{2+} $) a été oxydé en ($ Fe^{3+} $).
Le sens des réactions d'oxydoréduction est déterminé par les valeurs des potentiels d'oxydoréduction $ E $ des couples oxydant / réducteur mis en jeu.
Pour en savoir plus :
 S'abonner à un flux RSS
S'abonner à un flux RSS